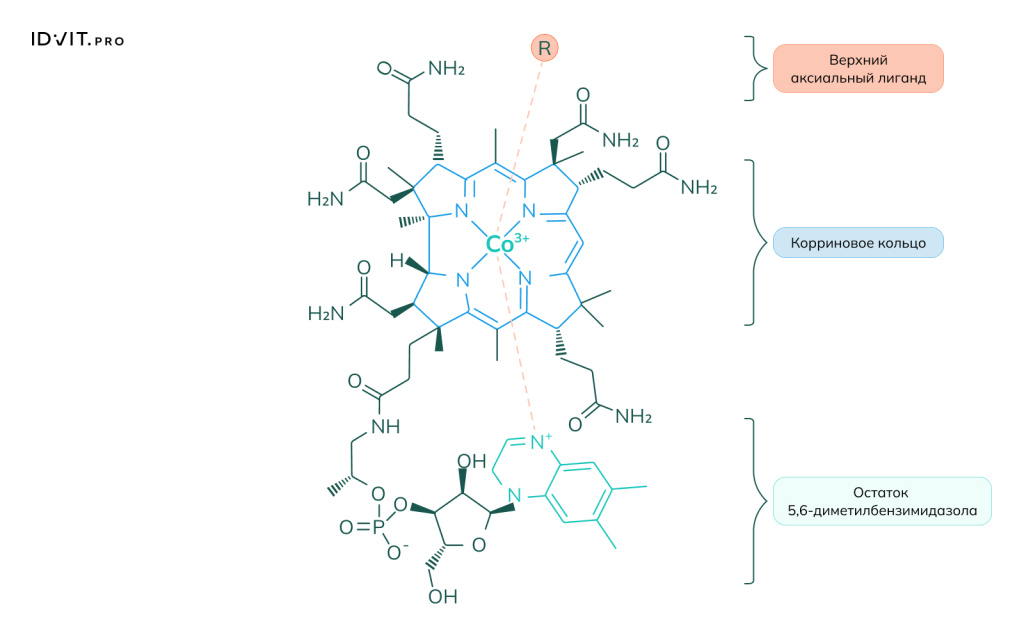
Витамин В12
Шаблон
нутрицифтической формулы
Витамин В12
Витамин B12 (кобаламин) — это водорастворимый витамин, необходимый для здоровья нервной системы и кроветворения, а также для производства ДНК и энергетического обмена. Он содержится в продуктах животного происхождения и в организме человека не вырабатывается, а накапливается в печени. Дефицит B12 может привести к анемии, неврологическим проблемам, усталости и снижению когнитивных функций.
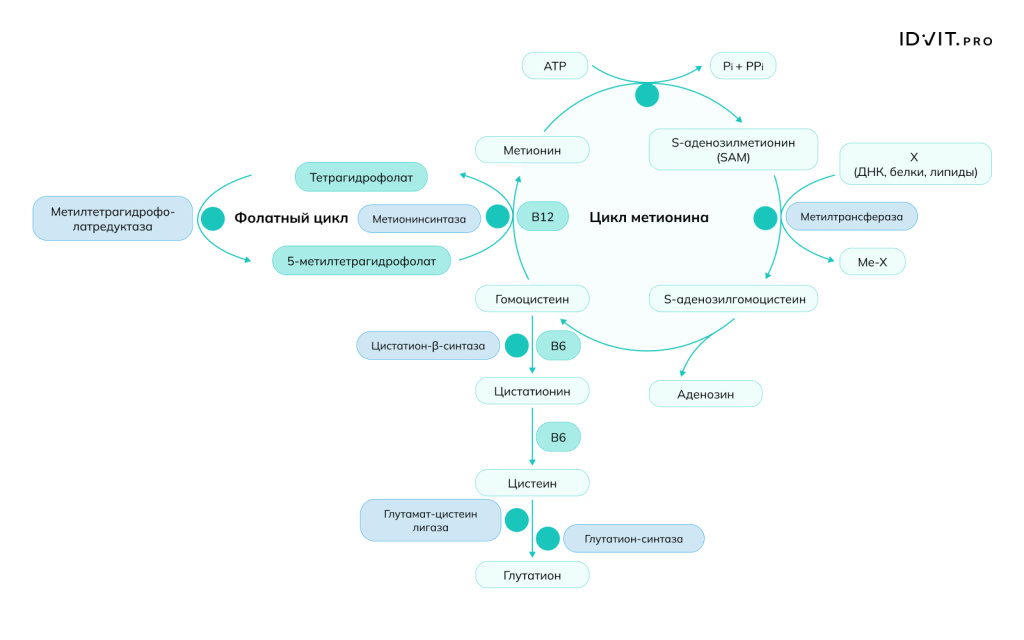
1. B12 действует как кофактор для метионинсинтазы, которая катализирует превращение гомоцистеина в метионин. Метионин, полученный в этой реакции, затем превращается в S-аденозилметионин (SAM) — универсальный донор метильных групп. Однако, что еще важнее, реакция, катализируемая метионинсинтазой, напрямую связана с метаболизмом фолатов. Она регенерирует тетрагидрофолат (THF) из 5-метилтетрагидрофолата. Без витамина B12 фолат «застревает» в форме 5-метил-THF, что приводит к функциональному дефициту фолиевой кислоты [O'Leary & Samman, 2010]. Это нарушает синтез пуринов и тимидина — нуклеотидов, необходимых для построения ДНК. Участие B12 впревращении гомоцистеина в метионин делает его одним из ключевых витаминов в регуляции уровня гомоцистеина в плазме. Гипергомоцистеинемия (повышенный уровень гомоцистеина) считается независимым фактором риска развития сердечно-сосудистых заболеваний, атеросклероза и тромбозов, так как гомоцистеин повреждает эндотелий сосудов и способствует пролиферации гладкомышечных клеток [O'Leary & Samman, 2010].
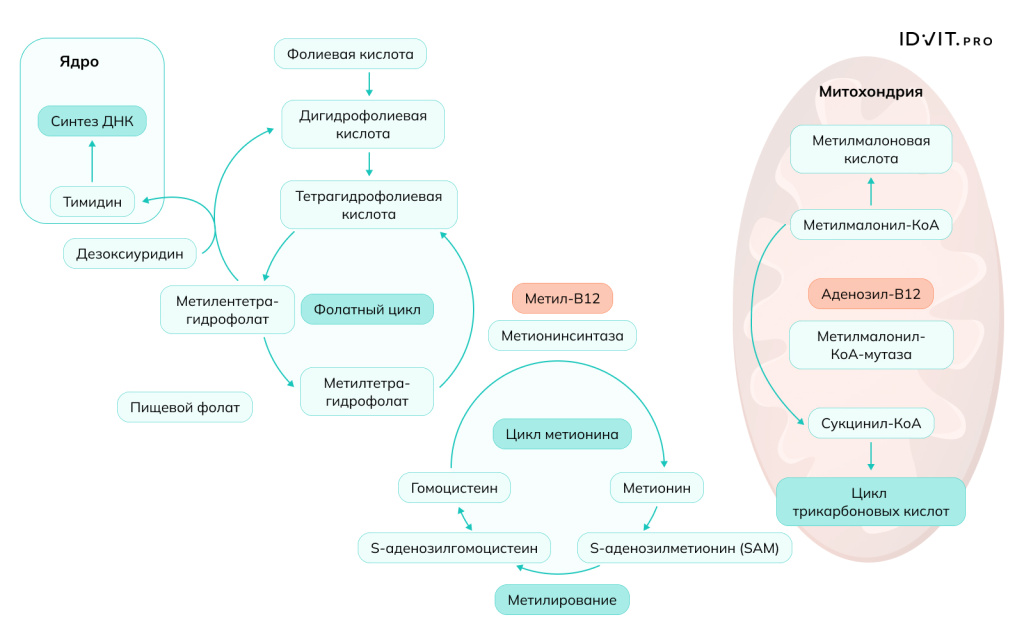
Витамин B12 абсолютно необходим для поддержания целостности нервной системы. Его роль в неврологическом здоровье многогранна – это синтез миелина, нейромедиаторов. Донор метильных групп SAM, регенерация которого зависит от B12, участвует в метилировании фосфолипидов и белков, входящих в состав миелиновой оболочки нервных волокон. Дефицит B12 приводит к нарушению синтеза и демиелинизации — разрушению миелиновой оболочки, что нарушает проведение нервных импульсов [Miller, 2018]. SAM также участвует в производстве таких нейромедиаторов, как дофамин и серотонин, что связывает уровень B12 с когнитивными функциями и настроением. Дефицит B12 приводит к накоплению метилмалоновой кислоты и гомоцистеина, которые могут оказывать прямое токсическое действие на нейроны [Hannibal et al., 2016].
2. Вторая ключевая ферментативная реакция с участием витамина B12 катализируется L-метилмалонил-КоА-мутазой, для которой коферментом является аденозилкобаламин.
Превращение метилмалонил-КоА в сукцинил-КоА: этот фермент преобразует метилмалонил-КоА в сукцинил-КоА, который является ключевым интермедиатом цикла Кребса (цикла трикарбоновых кислот) [Green & Miller, 2020]. Эта реакция позволяет продуктам распада некоторых жирных кислот (с нечетным числом атомов углерода) и некоторых аминокислот (валин, изолейцин, треонин, метионин) войти в цикл Кребса для производства энергии. При дефиците B12 активность мутазы падает, что приводит к накоплению предшественника — метилмалониловой кислоты (ММА). Повышенный уровень ММА в крови и моче является высокоспецифичным маркером дефицита витамина B12 [Hannibal et al., 2016].
Всасывание и транспорт В12
В пище (мясо, рыба, молочные продукты) витамин B12 прочно связан с белками. Процесс всасывания начинается в желудке: соляная кислота, выделяемая париетальными клетками желудка, денатурирует пищевые белки. Пепсины, активные в кислой среде, расщепляют белки, высвобождая витамин B12 в свободную форму. Как только B12 высвобождается, он немедленно связывается с белком-переносчиком (R-белок, или гаптокоррин). Этот белок вырабатывается слюнными железами и клетками желудка. R-белок защищает B12 от разрушения в агрессивной кислой среде желудка. Комплекс «B12 + R-белок» проходит дальше в тонкий кишечник. Далее следует расщепление комплекса в двенадцатиперстной кишке и связывание с Внутренним Фактором (ВФ, фактор Касла – гликопротеин, который синтезируется и секретируется париетальными клетками слизистой оболочки желудка и защищает В12 от действия пищеварительных ферментов) - это ключевой этап всасывания В12.
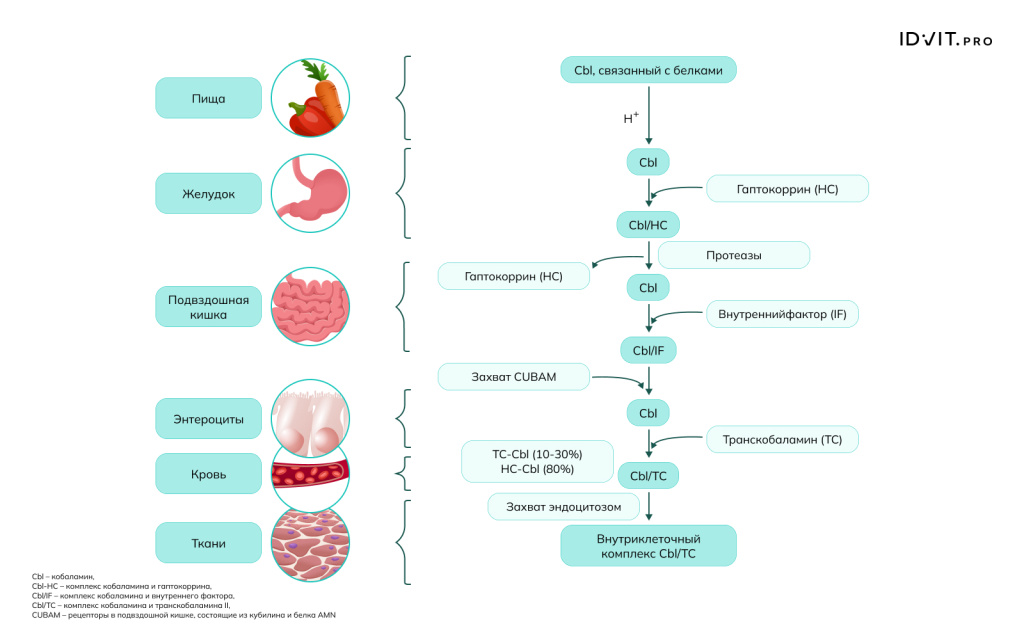
На поверхности клеток слизистой оболочки подвздошной кишки (энтероцитах) существуют специальные рецепторы, которые распознают и связывают исключительно комплекс «B12-Внутренний Фактор». Связывание и последующее всасывание требуют присутствия ионов кальция (Ca²⁺), которые обычно есть в кишечном соке. Рецептор-комплекс поглощается энтероцитом путем эндоцитоза. Внутри клетки комплекс разрушается, ВФ расщепляется, а свободный B12 попадает в портальный кровоток. После всасывания в кровь витамину B12 нужен новый переносчик, чтобы добраться до печени и других органов:
- Транскобаламин II (TCII): в крови витамин B12 связывается с белком плазмы транскобаламином II (TCII). Этот комплекс доставляет B12 к клеткам-мишеням по всему организму (печень, костный мозг, нервная система).
- Клеточный захват: клетки имеют рецепторы к транскобаламину II, поглощают комплекс и используют витамин B12 для своих метаболических нужд (например, синтеза ДНК и образования миелина).
- Пассивная диффузия (альтернативный, малоэффективный путь). Именно на этом механизме основана эффективность высокодозных пероральных препаратов B12 для лечения дефицита, даже у пациентов с пернициозной анемией (когда ВФ отсутствует). При приеме очень высоких доз B12 (более 100-200 мкг за раз) около 1% витамина может всосаться по всему протяжению кишечника путем простой диффузии, минуя все этапы с ВФ [Mucha et al., 2024].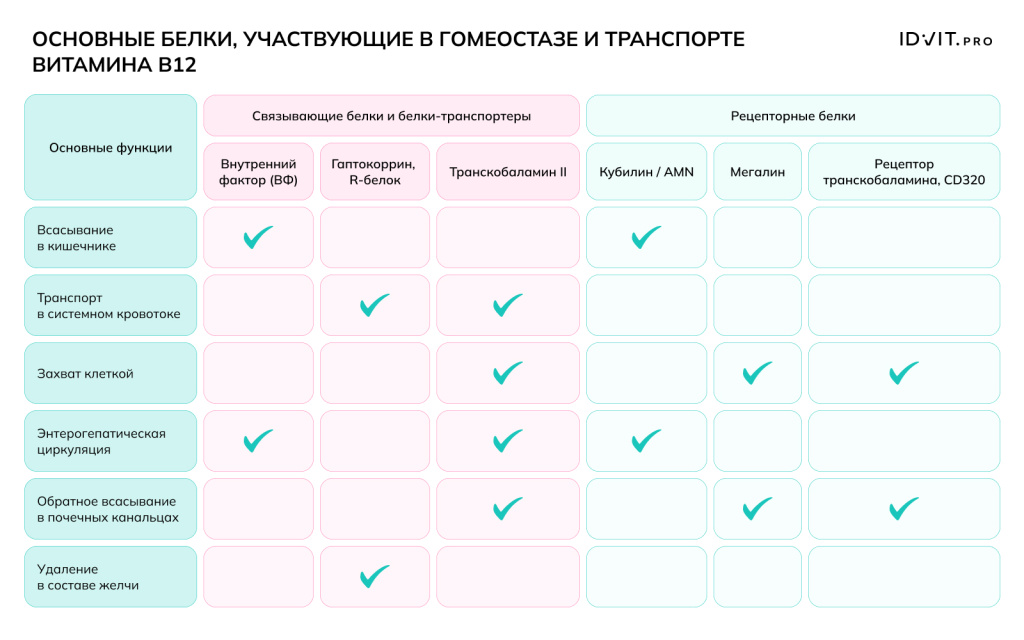
Дефицит В12
В странах с высоким уровнем дохода основным фактором риска развития дефицита витамина B12 является аутоиммунное заболевание — пернициозная анемия. Она вызвана отсутствием выработки внутреннего фактора париетальными клетками желудка, который необходим для всасывания B12 в кишечнике, и в конечном итоге приводит к развитию анемии и/или тяжелых неврологических симптомов. Пернициозная анемия может поражать людей любого возраста, но ее заболеваемость возрастает с годами. По разным оценкам пернициозной анемией страдают 2–3% людей в возрасте старше 65 лет. Кроме того, важными факторами риска являются операции на желудочно-кишечном тракте, такие как шунтирование желудка или удаление подвздошной кишки, которые нарушают всасывание B12. В странах с низким уровнем дохода дефицит
B12 чаще всего бывает вызван недостатком животной пищи в рационе питания и, вероятно, желудочно-кишечными инфекциями и инвазиями. Избыточный рост Helicobacter pylori, избыточный бактериальный рост в кишечнике могут дополняться плохим питанием, алкоголизмом, курением и длительным приемом ингибиторов протонной помпы, антагонистов H2-гистаминовых рецепторов и метформином. Различные заболевания, включая малярию, ВИЧ-инфекцию и туберкулез, могут способствовать развитию дефицита.
Вместе с тем, не являясь причиной основного заболевания, дефицит B12 может влиять на течение заболеваний, например, ухудшать состояние пациентов с ВИЧ-инфекцией. Считается, что и индивидуальные, и социальные факторы (социально-экономический статус, религия, культурные практики и политика в области общественного здравоохранения) влияют на статус витамина B12 в популяции [Solomon, 2007].
Состояния, вызывающие дефицит витамина B12, и их патогенетические основы:
Пернициозная анемия: недостаточное всасывание B12, вызванное дефицитом внутреннего фактора (обычно вследствие аутоиммунного заболевания).
Врожденные генетические особенности: полиморфизм генов, кодирующих белки-транспортеры, участвующие в обменных процессах с участием витамина В12, - TCN2 (транскобаламин II), FUT2 (фукозилтрансфераза, влияющая на состав микробиоты кишечника), MTR (метионинсинтаза), MTRR (метионинсинтаза-редуктаза), CUBN (кубилин – рецептор, опосредующий эндоцитоз комплекса витамин В12-внутренний фактор), MMACHC (белок, регулирующий образование MeCbl и AdoCbl внутри клетки) [Green et al., 2017].
Заболевания или операции на желудке (частичная или полная гастрэктомия или операция по уменьшению желудка): дефицит внутреннего фактора.
Хронический атрофический гастрит (хроническое воспаление, приводящее к утрате париетальных клеток, вырабатывающих желудочный сок) и приём лекарств, влияющих на секрецию желудочной кислоты или pH желудка (таких как ингибиторы протонной помпы, антагонисты H2-рецепторов и антациды): B12 не высвобождается из пищевого матрикса из-за недостатка соляной кислоты и низкой активности пепсина.
Заболевания поджелудочной железы или панкреатэктомия: B12 не высвобождается из комплекса с гаптокоррином из-за недостаточной активности ферментов поджелудочной железы.
Другие заболевания кишечника, резекция подвздошной кишки, паразитарные инвазии и избыточный бактериальный рост: нарушение всасывания комплекса B12–внутренний фактор.
Лекарственные средства, влияющие на всасывание или метаболизм B12: снижение уровня B12 в сыворотке крови (холестирамин, метформин).
Алиментарные (пищевые) факторы, такие как общее недоедание, вегетарианская или веганская диета и хронический алкоголизм: сниженное потребление B12.
Прочие причины: например, ВИЧ-инфекция и применение закиси азота для анестезии.
Основным природным источником витамина B12 для человека являются продукты животного происхождения: мясо, субпродукты, яйца, молочные продукты. В растениях данный витамин отсутствует, что создает фундаментальную проблему для людей, придерживающихся веганской и, в меньшей степени, вегетарианской диеты. Эпидемиологические исследования демонстрируют высокую распространенность дефицита и субоптимального статуса B12 среди веганов и вегетарианцев.
Систематический обзор и мета-анализ (Pawlak et al., 2014) показал, что у веганов, не принимающих добавки, распространенность дефицита витамина B12 достигает 62%, а у лакто-ово-вегетарианцев – 29%. Даже при отсутствии явных клинических симптомов, низкий уровень B12 является распространенным явлением в этих группах, что подтверждается исследованиями, отмечающими повышенный уровень гомоцистеина у значительной части испытуемых (Gilsing et al., 2010). Единственным пищевым источником В12 для веганов и вегетарианцев являются специализированные обогащенные продукты, но их состав и степень обогащения варьируются, что делает результат их потребления непредсказуемым. Особую озабоченность вызывает дефицит B12 у детей, рожденных от матерей-веганок, находящихся на грудном вскармливании. Неадекватный статус B12 у матери приводит к его недостатку у младенца, что может вызвать задержку развития, гипотонию и серьезные неврологические расстройства (Rogne et al., 2017).
Последствия дефицита
1. Гематологические последствия: мегалобластная анемия
Нарушение синтеза ДНК приводит к неэффективному эритропоэзу в костном мозге. Клетки-предшественники не могут завершить деление, что приводит к образованию аномально крупных и хрупких клеток – мегалобластов. Это проявляется в виде мегалобластной анемии, которая проявляется увеличением среднего объема эритроцитов, общими симптомами анемии (слабость, утомляемость, бледность кожных покровов, одышка), панцитопенией (снижение уровня лейкоцитов и тромбоцитов с соответствующим повышением риска инфекций и кровоточивости [Green & Datta, 2019].
2. Неврологические последствия
Неврологические повреждения, вызванные дефицитом В12, могут возникать независимо от наличия анемии и являются потенциально необратимыми, если лечение не начато своевременно [Hunt et al., 2014]. Они связаны с нарушением синтеза миелина и накоплением токсичных метаболитов (например, метилмалоновой кислоты). Симптомы и синдромы, наблюдающиеся при дефиците В12: периферическая нейропатия, поражение задних канатиков спинного мозга (фуникулярный миелоз), когнитивные нарушения (ухудшение памяти, замедленность мышления, деменция, депрессия и психозы) [Moore et al., 2012].
3. Сердечно-сосудистые последствия: гипергомоцистеинемия и повышение риска атеросклероза, тромбозов и сердечно-сосудистых заболеваний [Ganguly & Alam, 2015].
4. Другие последствия
- Эпителиальные изменения: vожет наблюдаться глоссит Хантера – воспаление и атрофия сосочков языка, приводящая к его ярко-красному, «лакированному» виду.
- Нарушения со стороны ЖКТ: потеря аппетита, диарея или запор.
- Бесплодие: дефицит В12 может негативно влиять на сперматогенез у мужчин и овуляцию у женщин.
Взаимодействие В12 и других микронутриентов
Взаимодействие витамина B12 с другими микронутриентами представляет собой сложную сеть синергических и антагонистических отношений, которые критически важны для поддержания гомеостаза.
Синергические взаимодействия
1. Фолат (Витамин B9)
Это наиболее значимое и хорошо изученное синергическое взаимодействие витамина B12. Витамин B12 выступает в роли кофактора для фермента метионинсинтазы. Одновременно с этой реакцией происходит превращение 5-метилтетрагидрофолата (неактивная форма фолата) в тетрагидрофолат (активная форма), который необходим для синтеза ДНК и деления клеток. Без адекватного уровня B12 фолат «застревает» в форме 5-метил-ТГФ, возникает функциональный дефицит фолата, известный как «фолатная ловушка». Это приводит к нарушению синтеза ДНК и мегалобластной анемии, которую невозможно вылечить приемом одного лишь фолата (Green & Miller, 2022). Клиническое значение: Дефицит любого из этих витаминов приводит к накоплению гомоцистеина, что является независимым фактором риска сердечно-сосудистых заболеваний и нарушений когнитивных функций (Selhub et al., 2010).
2. Витамин B6 (Пиридоксин)
B6 действует синергически с B12 и фолатом в цикле метилирования. Витамин B6 является кофактором для других ферментов метаболизма гомоцистеина, в частности цистатионин-β-синтазы, которая превращает гомоцистеин в цистатионин в процессе транссульфурации. Хотя это независимый от B12 путь, адекватный уровень всех трех витаминов (B6, B9, B12) необходим для эффективного поддержания низкого уровня гомоцистеина в плазме (Maron & Loscalzo, 2020).
3. Железо
Взаимодействие между B12 и железом является косвенным, но клинически важным. Витамин B12 необходим для синтеза эритроцитов в костном мозге. При дефиците B12 развивается мегалобластная анемия, характеризующаяся производством крупных, но незрелых эритроцитов. Эта анемия может маскировать или усугублять железодефицитную анемию. Исследования показывают, что у пациентов с дефицитом B12 часто наблюдается сопутствующий дефицит железа, возможно, из-за нарушения утилизации железа или атрофического гастрита, который снижает абсорбцию как B12 (из-за недостатка внутреннего фактора Касла), так и железа (Obeid et al., 2019).
Антагонистические взаимодействия
Витамин С (аскорбиновая кислота)
Взаимодействие является дозозависимым и в значительной степени связано с условиями в желудочно-кишечном тракте. Высокие дозы витамина С (особенно в виде добавок, принимаемых одновременно с B12) могут разрушать витамин B12 в пищеварительном тракте, так как аскорбиновая кислота в кислой среде может способствовать деградации кобаламина (Herbert, 2019). Однако это актуально для фармакологических доз (более 500 мг), принятых в одно и то же время с пищей или добавками B12. Рекомендуется разделять прием высоких доз витамина С и витамина B12 на несколько часов, чтобы минимизировать потенциальное разрушение. В обычных пищевых дозах витамин С не оказывает значительного негативного влияния на статус B12.
Кальций
Это взаимодействие является примером того, как один минерал может быть необходим для абсорбции другого микронутриента, и его недостаток действует как функциональный антагонист. Абсорбция витамина B12 в подвздошной кишке зависит от его связывания с внутренним фактором (ВФ). Этот процесс является кальций-зависимым. Дефицит кальция может нарушить этот процесс и привести к снижению абсорбции B12 (Ralph & Sharma, 2021). Это особенно актуально для пациентов, длительно принимающих ингибиторы протонной помпы (ИПП) и блокаторы H2-гистаминовых рецепторов, которые снижают кислотность желудка и, следовательно, абсорбцию кальция.
Калий
Высокий уровень калия может усугублять проявления дефицита B12. Хотя механизм не до конца ясен, считается, что гипокалиемия (низкий уровень калия) может быть спровоцирована началом лечения тяжелого дефицита витамина B12. Быстрое образование новых клеток крови и других тканей активно потребляет калий из кровотока. У пациентов с погранично низким уровнем калия это может привести к клинически значимой гипокалиемии (Stabler, 2020). Таким образом, высокий исходный уровень калия не является прямым антагонистом, но его нормальный уровень необходим для безопасной коррекции дефицита B12.
Взаимодействие витамина B12 с другими микронутриентами является ярким примером метаболической интеграции. Его синергизм с фолатом и железом лежит в основе нормального кроветворения и профилактики гипергомоцистеинемии. В то же время, антагонизм с высокими дозами витамина С и функциональная зависимость от кальция демонстрируют важность сбалансированного подхода к нутритивной поддержке. Понимание этих взаимодействий необходимо для эффективной профилактики и коррекции дефицитных состояний, а также для разработки оптимальных режимов приема пищевых добавок.
 Вход
Вход